Modelos atômicos:
Leucipo de Mileto Demócrito
Leucipo dizia que a matéria podia ser dividida em partículas cada vez menores, até chegar-se a um limite.
O filósofo grego Leucipo e seu discípulo Demócrito imaginaram a matéria como sendo constituída por pequenas partículas indivisíveis - os átomos, como lhes chamaram. Concluiram que a matéria não poderia ser infinitamente divisível. Se a partíssemos variadas vezes, chegaríamos a uma partícula muito pequena, indivisível e impenetrável a que se denominou átomo.
John Dalton
Dalton afirmava que o átomo era a partícula elementar, a menor partícula que constituía a matéria. Em 1.808, Dalton apresentou seu modelo atômico: o átomo como uma minúscula esfera maciça, indivisível, impenetrável e indestrutível. Dalton, ao contrário de Demócrito e Leucipo, utilizou de métodos experimentais, dando maior credibilidade ao seu modelo. Seu modelo atômico também é conhecido como "modelo da bola de bilhar".
Para ele, todos os átomos de um mesmo elemento químico são iguais, até mesmo as suas massas. Dalton estava completamente enganado ao afirmar isto, e Thomsom demonstrou que os mesmos podiam ser interpretados como sendo um feixe de partículas carregadas de energia elétrica negativa, as quais foram chamadas de elétrons.
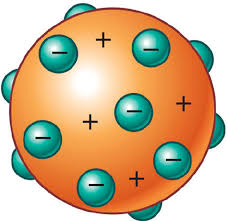
J. J. Thomsom
Utilizando campos magnéticos e elétricos, Thomson conseguiu determinar a relação entre a carga e a massa do elétron. Ele conclui que os elétrons (raios catódicos) deveriam ser constituintes de todo tipo de matéria pois observou que a relação carga/massa do elétron era a mesma para qualquer gás que fosse colocado na Ampola de Crookes (tubo de vidro rarefeito no qual se faz descargas elétricas em campos elétricos e magnéticos). Com base em suas conclusões, Thomson colocou por terra o modelo do átomo indivisível e apresentou seu modelo, conhecido também como o "modelo de pudim com passas"
Modelo de Thomsom
Resumo da linha de raciocínio de Thomsom :
a matéria é formada por partículas extremamente pequenas chamadas átomos;
os átomos são esferas maciças, indestrutíveis e intransformáveis;
Átomos que apresentam mesmas propriedades (tamanho, massa e forma) constituem um elemento químico;
Átomos de elementos diferentes possuem propriedades diferentes;
os átomos podem se unir entre si formando "átomos compostos";
uma reação química nada mais é do que a união e separação de átomos
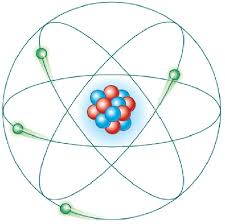
Ernest Rutherford
As bases para o desenvolvimento da física nuclear foram lançadas por Ernest Rutherford ao desenvolver sua teoria sobre a estrutura atômica. O cientista estudou por três anos o comportamento dos feixes de partículas ou raios X, além da emissão de radioatividade pelo elemento Urânio. Uma das inúmeras experiências realizadas foi a que demonstrava o espalhamento das partículas alfa. Esta foi base experimental do modelo atômico do chamado átomo nucleado onde elétrons orbitavam em torno de um núcleo. Durante suas pesquisas Rutherford observou que para cada 10.000 partículas alfa aceleradas incidindo numa lâmina de ouro, apenas uma refletia ou se desviava de sua trajetória. A conclusão foi que o raio de um átomo poderia ser em torno de 10.000 vezes maior que o raio de seu núcleo.
Experimento de Rutherford
Modelo atômico de Rutherford
Niels Bohr
Bohr apresentou alterações ao modelo de Rutherford: os elétrons só podem ocupar níveis de energia bem definidos, e os elétrons giram em torno do núcleo em órbitas com energias diferentes. As órbitas interiores apresentam energia mais baixa e à medida que se encontram mais afastadas do núcleo o valor da sua energia é maior. Quando um elétron recebe energia suficiente passa a ocupar uma órbita mais externa (com maior energia) ficando o átomo num estado excitado. Se um elétron passar de uma órbita para uma outra mais interior liberta energia.
Os elétrons tendem a ter a menor energia possível - estado fundamental do átomo.
Os elétrons tendem a ter a menor energia possível - estado fundamental do átomo.
Modelo atômico de Niels Bohr
Bibliografia
Aluno: Igor Fernandes Freitas










valeu me ajudou muito :)
ResponderExcluirchupa meu cuzinho
ResponderExcluirClaro vem aqui q eu chupo !!! DELÍCIA !!!
ExcluirQ DLÇ!!!! aaaah, aaaaaaaaaaaaaaaah
Excluirvaleu parceiro blz mano vc é legal .muito obrigado chapa!!!
ResponderExcluirkkk que ótario chupa (meu cuzinho) hum..... ausdhaudhasuhdasuhda
ResponderExcluiraposto q são mulheres se for chupo e como vcs se forem gostosas e bonitas.
ResponderExcluirme ajudou muito rsrsrsrs....
ResponderExcluirLegal, maneiro.
ResponderExcluirAjudou mt cara, vlw.
ResponderExcluir. cris
obrigada;)
ResponderExcluirEste comentário foi removido pelo autor.
ResponderExcluir