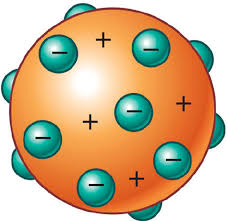
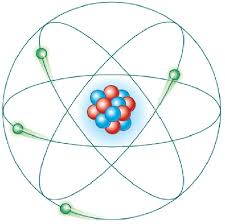
O Átomo de Dalton (1803)
John Dalton foi o criador da primeira teoria atômica moderna na passagem do século XVIII para o século XIX. Em 1803, Dalton propôs a teoria do modelo atômico, onde o átomo é uma minúscula esfera maciça, impenetrável, indestrutível, indivisível e sem carga (carga neutra) e que todos os átomos de um mesmo elemento químico são idênticos. Seu modelo atômico foi chamado de modelo atômico da bola de bilhar. Para Dalton o átomo era um sistema contínuo. Apesar de um modelo simples, Dalton deu um grande passo na elaboração de um modelo atômico, pois foi o que instigou na busca por algumas respostas e proposição de futuros modelos. Modelo de Dalton: A matéria é constituída de diminutas partículas amontoadas como laranjas. Com base em estudos de outros cientistas anteriores a ele, John Dalton propôs um modelo de átomo onde pregava as seguintes idéias:
Toda matéria é composta por átomos; os átomos são indivisíveis; os átomos não se transformam uns nos outros; os átomos não podem ser criados nem destruídos; os elementos químicos são formados por átomos simples; os átomos de determinado elemento são identicos entre si em tamanho, forma, massa e demais propriedades; átomos de elementos diferentes são diferentes entre si; toda reação química consiste na união ou separação de átomos; átomos iguais entre si se afastam e átomos diferentes se atraem; substâncias compostas são formadas por átomos compostos (as atuais moléculas); átomos compostos são formados a partir de elementos diferentes, em uma relação numérica simples.
O Átomo de Thomsom (1898)
Thomsom derrubou a idéia de que o átomo era indivisível. Com os dados disponíveis na época, propôs um modelo mais coerente do que o de Dalton. Para Thomsom a massa do átomo era a massa das partículas positivas e as partículas neutras. Os elétrons não seriam levados em conta por serem muito leves. Ainda mais, ele dividiu o átomo em duas partes distintas: uma delas ele chamou de núcleo e neste núcleo existiam cargas positivas e as partículas neutras. Este núcleo era praticamente todo o volume do átomo. Uma outra parte do átomo era composta de elétrons (cargas negativas) que uniformemente distribuídos entre as positivas e neutras, garantiam o equilíbrio elétrico. Thomsom descobre os elétrons.
O Átomo de Rutherford (1911)
Este cientista sabia que o polônio e o rádio eram emissores naturais de partículas alfa. A partir dessas informações idealizou a sua famosa experiência tentando provar que Thomsom estava certo em suas idéias sobre o átomo. A experiência consistia em bombardear uma lâmina fina de ouro com as partículas alfa emitidas pelo polônio. Para conseguir um feixe de partículas alfa, foi utilizado um anteparo de chumbo, provido de uma fenda, de maneira que só passassem pelo chumbo as partículas que incidissem na fenda. Tomou cuidado de colocar atrás da lâmina de ouro, um outro anteparo tratado com sulfeto de zinco, que é uma substância que se ilumina quando uma partícula radioativa o atinge. Rutherford esperava que as partículas alfa atravessassem a lâmina de ouro quase sem desvios, se tudo desse certo à luz do modelo de Thomsom. Mas os desvios foram muito mais intensos do que se poderia supor e algumas até refletiam. Foi a partir desta experiência que Rutherford colocou para o meio científico as suas idéias. A idéia de Thomsom de que o átomo tem um núcleo com prótons e neutrons foi mantida, mas com modificações estruturais importantes. Propôs que os átomos seriam constituídos por um núcleo muito denso, carregado positivamente, onde se concentraria praticamente toda a massa. Ao redor desse centro positivo, ficariam os elétrons, distribuídos espaçadamente. Comparou seu modelo ao sistema solar, onde o Sol seria o núcleo, e os planetas, os elétrons.
Gabriella Furtado
segunda-feira, 29 de março de 2010
O diâmetro da eletrosfera de um átomo é de 10.000 a 100.000 vezes maior que o diâmetro de seu núcleo.Sua estrutura externa pode ser considerada oca, pois para encher todo esse espaço vazio de prótons e nêutrons necessitaríamos de um bilhão de milhões de núcleos.O átomo de hidrogênio é constituido por um só próton e um único elétron girando ao seu redor, o hidrogênio é o único elemento cujo átomo não possui nêutrons. Os prótons(positivos) e os elétrons(negativos),além de não terem a mesma carga, tem massas diferentes, o próton é 1.836,11 vezes mais massivo que o elétron, o que faz com que 99,97% de sua massa se encontre no núcleo.
John Dalton
Dalton desenvolveu sua teoria atômica numa série de conferências que proferiu na Royal Institution de Londres, nos anos de 1805 e 1804. Em 1807, com o seu consentimento, Thomas Thomson incluiu um sumário da teoria atômica na terceira edição de sua obra System of chemistry (Sistema de química). O próprio Dalton, no ano seguinte, no primeiro volume do seu New system of chemical philosophy (Novo sistema de filosofia química), apresentou as bases de sua nova teoria.
Partindo, então, das investigações sobre a composição dos diferentes óxidos de nitrogênio, Dalton estabeleceu a lei das proporções múltiplas, conhecida também como lei de Dalton.
A lei de Dalton pode ser assim enunciada:
Se a massa m de uma substância química S pode combinar-se com as massas m’1, m’2, m’3 etc. de uma substância S’, dando origem a compostos distintos, as massas da substância S’ estarão entre si numa relação de números inteiros e simples.
Para o estabelecimento dessa lei, Dalton baseou-se na sua teoria atômica. Recorde-se, todavia, que sua teoria fundamentava-se no princípio de que os átomos de determinado elemento eram iguais e de peso invariável. Na época em que ele estabeleceu essa lei não eram ainda conhecidas as fórmulas moleculares dos compostos. Determinavam-se, porém, experimentalmente, com certa aproximação, as proporções ponderais dos elementos constituintes dos compostos.Dalton desenvolveu sua teoria atômica numa série de conferências que proferiu na Royal Institution de Londres, nos anos de 1805 e 1804. Em 1807, com o seu consentimento, Thomas Thomson incluiu um sumário da teoria atômica na terceira edição de sua obra System of chemistry (Sistema de química). O próprio Dalton, no ano seguinte, no primeiro volume do seu New system of chemical philosophy (Novo sistema de filosofia química), apresentou as bases de sua nova teoria.
Partindo, então, das investigações sobre a composição dos diferentes óxidos de nitrogênio, Dalton estabeleceu a lei das proporções múltiplas, conhecida também como lei de Dalton.
A lei de Dalton pode ser assim enunciada:
Se a massa m de uma substância química S pode combinar-se com as massas m’1, m’2, m’3 etc. de uma substância S’, dando origem a compostos distintos, as massas da substância S’ estarão entre si numa relação de números inteiros e simples.
Para o estabelecimento dessa lei, Dalton baseou-se na sua teoria atômica. Recorde-se, todavia, que sua teoria fundamentava-se no princípio de que os átomos de determinado elemento eram iguais e de peso invariável. Na época em que ele estabeleceu essa lei não eram ainda conhecidas as fórmulas moleculares dos compostos. Determinavam-se, porém, experimentalmente, com certa aproximação, as proporções ponderais dos elementos constituintes dos compostos.
Tainan Pereira
Partindo, então, das investigações sobre a composição dos diferentes óxidos de nitrogênio, Dalton estabeleceu a lei das proporções múltiplas, conhecida também como lei de Dalton.
A lei de Dalton pode ser assim enunciada:
Se a massa m de uma substância química S pode combinar-se com as massas m’1, m’2, m’3 etc. de uma substância S’, dando origem a compostos distintos, as massas da substância S’ estarão entre si numa relação de números inteiros e simples.
Para o estabelecimento dessa lei, Dalton baseou-se na sua teoria atômica. Recorde-se, todavia, que sua teoria fundamentava-se no princípio de que os átomos de determinado elemento eram iguais e de peso invariável. Na época em que ele estabeleceu essa lei não eram ainda conhecidas as fórmulas moleculares dos compostos. Determinavam-se, porém, experimentalmente, com certa aproximação, as proporções ponderais dos elementos constituintes dos compostos.Dalton desenvolveu sua teoria atômica numa série de conferências que proferiu na Royal Institution de Londres, nos anos de 1805 e 1804. Em 1807, com o seu consentimento, Thomas Thomson incluiu um sumário da teoria atômica na terceira edição de sua obra System of chemistry (Sistema de química). O próprio Dalton, no ano seguinte, no primeiro volume do seu New system of chemical philosophy (Novo sistema de filosofia química), apresentou as bases de sua nova teoria.
Partindo, então, das investigações sobre a composição dos diferentes óxidos de nitrogênio, Dalton estabeleceu a lei das proporções múltiplas, conhecida também como lei de Dalton.
A lei de Dalton pode ser assim enunciada:
Se a massa m de uma substância química S pode combinar-se com as massas m’1, m’2, m’3 etc. de uma substância S’, dando origem a compostos distintos, as massas da substância S’ estarão entre si numa relação de números inteiros e simples.
Para o estabelecimento dessa lei, Dalton baseou-se na sua teoria atômica. Recorde-se, todavia, que sua teoria fundamentava-se no princípio de que os átomos de determinado elemento eram iguais e de peso invariável. Na época em que ele estabeleceu essa lei não eram ainda conhecidas as fórmulas moleculares dos compostos. Determinavam-se, porém, experimentalmente, com certa aproximação, as proporções ponderais dos elementos constituintes dos compostos.
Tainan Pereira
Átomo de Bohr
Átomo de Bohr
Modelo do átomo de Bohr na física atômica, o átomo de Bohr é um modelo que descreve o átomo como um núcleo pequeno e carregado positivamente cercado por elétrons em órbita circular.
Ernest Rutherford, no início do século XX, faz o experimento de bombardear uma folha de ouro e, a partir da análise dessa experiência, afirma que átomos fossem constituídos de uma nuvem difusa de elétrons carregados negativamente que circundavam um núcleo atômico denso, pequeno e carregado positivamente.
A partir dessa descrição, é fácil deixar-se induzir por uma concepção de um modelo planetário para o átomo, com elétrons orbitando ao redor do "núcleo-sol". Porém, a aberração mais séria desse modelo é a perda de energia dos elétrons por radiação síncrotron: uma partícula carregada eletricamente e acelerada emite radiações eletromagnéticas que têm energia; fosse assim, ao orbitar em torno do núcleo atômico, o elétron deveria gradativamente emitir radiações e cada vez mais aproximar-se do núcleo, em uma órbita espiralada, até finalmente chocar-se com ele. Um cálculo rápido mostra que isso deveria ocorrer quase que instantaneamente.
Como o "colapso" atômico da forma descrita anteriormente obviamente não acontece, o físico dinamarquês Niels Bohr, baseando-se também nas ideias de Albert Einstein e Max Planck, propõe as seguintes ideias-chave:
Os elétrons que circundam o núcleo atômico existem em órbitas que têm níveis de energia quantizados
As leis da mecânica clássica não valem quando o elétron salta de uma órbita a outra
Quando ocorre o salto de um elétron entre órbitas, a diferença de energia é emitida (ou suprida) por um simples quantum de luz (também chamado de fóton), que tem energia exatamente igual à diferença de energia entre as órbitas em questão
As órbitas permitidas dependem de valores quantizados (discretos) de momento angular orbital, L, de acordo com a equação
onde n = 1, 2, 3, ... é chamado de número quântico principal e h é a constante de Planck.
Modelo do átomo de Bohr na física atômica, o átomo de Bohr é um modelo que descreve o átomo como um núcleo pequeno e carregado positivamente cercado por elétrons em órbita circular.
Ernest Rutherford, no início do século XX, faz o experimento de bombardear uma folha de ouro e, a partir da análise dessa experiência, afirma que átomos fossem constituídos de uma nuvem difusa de elétrons carregados negativamente que circundavam um núcleo atômico denso, pequeno e carregado positivamente.
A partir dessa descrição, é fácil deixar-se induzir por uma concepção de um modelo planetário para o átomo, com elétrons orbitando ao redor do "núcleo-sol". Porém, a aberração mais séria desse modelo é a perda de energia dos elétrons por radiação síncrotron: uma partícula carregada eletricamente e acelerada emite radiações eletromagnéticas que têm energia; fosse assim, ao orbitar em torno do núcleo atômico, o elétron deveria gradativamente emitir radiações e cada vez mais aproximar-se do núcleo, em uma órbita espiralada, até finalmente chocar-se com ele. Um cálculo rápido mostra que isso deveria ocorrer quase que instantaneamente.
Como o "colapso" atômico da forma descrita anteriormente obviamente não acontece, o físico dinamarquês Niels Bohr, baseando-se também nas ideias de Albert Einstein e Max Planck, propõe as seguintes ideias-chave:
Os elétrons que circundam o núcleo atômico existem em órbitas que têm níveis de energia quantizados
As leis da mecânica clássica não valem quando o elétron salta de uma órbita a outra
Quando ocorre o salto de um elétron entre órbitas, a diferença de energia é emitida (ou suprida) por um simples quantum de luz (também chamado de fóton), que tem energia exatamente igual à diferença de energia entre as órbitas em questão
As órbitas permitidas dependem de valores quantizados (discretos) de momento angular orbital, L, de acordo com a equação
onde n = 1, 2, 3, ... é chamado de número quântico principal e h é a constante de Planck.
Modelo atomico
John Dalton ( Modelo da bola de bilhar )
O professor da universidade inglesa New College de Manchester, John Dalton foi o criador da primeira teoria atômica moderna na passagem do século XVIII para o século XIX.
Em 1803 Dalton publicou o trabalho Absorption of Gases by Water and Other Liquids, (Absorção de gases pela água e outros líquidos), neste delineou os princípios de seu modelo atômico.
Segundo Dalton:
Átomos de elementos diferentes possuem propriedades diferentes entre si.
Átomos de um mesmo elemento possuem propriedades iguais e de peso invariável.
Átomos são partículas maciças, indivisíveis e esféricas formadoras da matéria.
Nas reações químicas, os átomos permanecem inalterados.
Na formação dos compostos, os átomos entram em proporções numéricas fixas 1:1, 1:2, 1:3, 2:3, 2:5 etc.
O peso total de um composto é igual à soma dos pesos dos átomos dos elementos que o constituem.
Em 1808, Dalton propôs a teoria do modelo atômico, onde o átomo é uma minúscula esfera maciça, impenetrável, indestrutível, indivisível e sem carga. Todos os átomos de um mesmo elemento químico são idênticos. Seu modelo atômico foi chamado de modelo atômico da bola de bilhar.
Em 1810 foi publicada a obra New System of Chemical Philosophy (Novo sistema de filosofia química), nesse trabalho havia testes que provavam suas observações, como a lei das pressões parciais, chamada de Lei de Dalton, entre outras relativas à constituição da matéria.
Os átomos são indivisíveis e indestrutíveis;
Existe um número pequeno de elementos químicos diferentes na natureza;
Reunindo átomos iguais ou diferentes nas variadas proporções, podemos formar todas as matérias do universo conhecidas;
Para Dalton o átomo era um sistema contínuo. Apesar de um modelo simples, Dalton deu um grande passo na elaboração de um modelo atômico, pois foi o que instigou na busca por algumas respostas e proposição de futuros modelos. Modelo de Dalton: A matéria é constituída de diminutas partículas amontoadas como laranjas.
Joseph John Thomson
A partir de uma experiência utilizando tubos de Crookes, Joseph John Thomson demonstrou que os raios catódicos podiam ser interpretados como um feixe de partículas carregadas negativamente e que possuíam massa. Concluiu que essas partículas negativas deviam fazer parte de quaisquer átomos, recebendo assim o nome de elétron.
O Modelo atômico de Thomson (1897) propunha então que se o átomo não fosse maciço (como havia afirmado John Dalton), mas sim um fluido com carga positiva (homogêneo e quase esférico) no qual estavam dispersos (de maneira homogênea) os elétrons. Podemos fazer a analogia desse modelo atômico com um "Panetone" ou com um pudim recheado de uvas passas, em que a massa do panetone seria positiva e as passas seriam as partículas negativas.
Ernest Rutherford
As bases para o desenvolvimento da física nuclear foram lançadas por Ernest Rutherford ao desenvolver sua teoria sobre a estrutura atômica. O cientista estudou por três anos o comportamento dos feixes de partículas ou raios X, além da emissão de radioatividade pelo elemento Urânio. Uma das inúmeras experiências realizadas, foi a que demonstrava o espalhamento das partículas alfa. Esta foi base experimental do modelo atômico do chamado átomo nucleado onde elétrons orbitavam em torno de um núcleo. Durante suas pesquisas Rutherford observou que para cada 10.000 partículas alfa aceleradas incidindo numa lâmina de ouro, apenas uma refletia ou se desviava de sua trajetória. A conclusão foi que o raio de um átomo poderia ser em torno de 10.000 vezes maior que o raio de seu núcleo. Rutherford e Frederick Soddy ainda, descobriram a existência dos raios gama e estabeleceram as leis das transições radioativas das séries do tório, do actínio e do rádio O modelo atômico de Rutherford ficou conhecido como modelo planetário, pela sua semelhança com a formação do Sistema Solar. Em 1911, Ernest Rutherford propôs o modelo de átomo com movimentos planetários. Este modelo foi estudado e aperfeiçoado por Niels Bohr, que acabou por demonstrar a natureza das partículas alfa como núcleos de hélio.
Niels Bohr
A teoria orbital de Rutherford encontrou uma dificuldade teórica resolvida por Niels Bohr.
No momento em que temos uma carga elétrica negativa composta pelos elétrons girando ao redor de um núcleo de carga positiva, este movimento gera uma perda de energia devido a emissão de radiação constante. Num dado momento, os elétrons vão se aproximar do núcleo num movimento em espiral e cair sobre si.
Em 1911, Niels Bohr publicou uma tese que demonstrava o comportamento eletrônico dos metais. Na mesma época, foi trabalhar com Ernest Rutherford em Manchester, Inglaterra. Lá obteve os dados precisos do modelo atômico, que iriam lhe ajudar posteriormente.
Em 1913, observando as dificuldades do modelo de Rutherford, Bohr intensificou suas pesquisas visando uma solução teórica.
Em 1916, Niels Bohr retornou para Copenhague para atuar como professor de física. Continuando suas pesquisas sobre o modelo atômico de Rutherford.
Em 1920, nomeado diretor do Instituto de Física Teórica, Bohr acabou desenvolvendo um modelo atômico que unificava a teoria atômica de Rutherford e a teoria da mecânica quântica de Max Planck.
Sua teoria consistia que ao girar em torno de um núcleo central, os elétrons deveriam girar em órbitas específicas com níveis energéticos bem definidos. Que poderia haver a emissão ou absorção de pacotes discretos de energia chamados de quanta ao mudar de órbita.
Realizando estudos nos elementos químicos com mais de dois elétrons, concluiu que se tratava de uma organização bem definida em camadas. Descobriu ainda que as propriedades químicas dos elementos eram determinadas pela camada mais externa.
Bohr enunciou o princípio da complementaridade, segundo o qual um fenômeno físico deve ser observado a partir de dois pontos de vista diferentes e não excludentes. Observou que existiam paradoxos onde poderia haver o comportamento de onda e de partícula dos elétrons, dependendo do ponto de vista.
Essa teoria acabou por se transformar na hipótese proposta por Louis de Broglie (Louis Victor Pierre Raymondi, sétimo duque de Broglie) onde todo corpúsculo atômico pode comportar-se de duas formas, como onda e como partícula.
Erwin Schrödinger, Louis Victor de Broglie e Werner Heisenberg
Erwin Schrödinger, Louis Victor de Broglie e Werner Heisenberg, reunindo os conhecimentos de seus predecessores e contemporâneos, acabaram por desenvolver uma nova teoria do modelo atômico, além de postular uma nova visão, chamada de mecânica ondulatória.
Fundamentada na hipótese proposta por Broglie onde todo corpúsculo atômico pode comportar-se como onda e como partícula, Heisenberg, em 1925, postulou o princípio da incerteza.
A idéia de órbita eletrônica acabou por ficar desconexa, sendo substituída pelo conceito de probabilidade de se encontrar num instante qualquer um dado elétron numa determinada região do espaço.
O átomo deixou de ser indivisível como acreditavam filósofos gregos antigos e Dalton. O modelo atômico portanto, passou a se constituir na verdade, de uma estrutura mais complexa.
O atual modelo atômico
Se sabe que os elétrons possuem carga negativa, massa muito pequena e que se movem em órbitas ao redor do núcleo atômico.
O núcleo atômico é situado no centro do átomo e constituído por prótons que são partículas de carga positiva, cuja massa é aproximadamente 1.837 vezes superior a massa do elétron, e por nêutrons, partículas sem carga e com massa ligeiramente superior à dos prótons.
O átomo é eletricamente neutro, por possuir números iguais de elétrons e prótons.
O número de prótons no átomo se chama número atômico, este valor é utilizado para estabelecer o lugar de um determinado elemento na tabela periódica.
A tabela periódica é uma ordenação sistemática dos elementos químicos conhecidos.
Cada elemento se caracteriza por possuir um número de elétrons que se distribuem nos diferentes níveis de energia do átomo correspondente.
Os níveis energéticos ou camadas, são denominados pelos símbolos K, L, M, N, O, P e Q.
Cada camada possui uma quantidade máxima de elétrons. A camada mais próxima do núcleo K, comporta somente dois elétrons; a camada L, imediatamente posterior, oito, e assim sucessivamente.
Os elétrons da última camada (mais afastados do núcleo) são responsáveis pelo comportamento químico do elemento, por isso são denominados elétrons de valência.
O número de massa é equivalente à soma do número de prótons e nêutrons presentes no núcleo.
O átomo pode perder elétrons, carregando-se positivamente, é chamado de íon positivo (cátion).
Ao receber elétrons, o átomo se torna negativo, sendo chamado íon negativo (ânion).
O deslocamento dos elétrons provoca uma corrente elétrica, que dá origem a todos os fenômenos relacionados à eletricidade e ao magnetismo.
No núcleo do átomo existem duas forças de interação a chamada interação nuclear forte, responsável pela coesão do núcleo, e a interação nuclear fraca, ou força forte e força fraca respectivamente.
As forças de interação nuclear são responsáveis pelo comportamento do átomo quase em sua totalidade.
As propriedades físico-químicas de um determinado elemento são predominantemente dadas pela sua configuração eletrônica, principalmente pela estrutura da última camada, ou camada de valência.
As propriedades que são atribuídas aos elementos na tabela, se repetem ciclicamente, por isso se denominou como tabela periódica dos elementos.
Os isótopos são átomos de um mesmo elemento com mesmo número de prótons (podem ter quantidade diferente de nêutrons).
Os isótonos são átomos que possuem o mesmo número de nêutrons
Os Isóbaros são átomos que possuem o mesmo número de massa
Através da radioatividade alguns átomos atuam como emissores de radiação nuclear, esta constitui a base do uso da energia atômica.
O atual modelo atômico
Se sabe que os elétrons possuem carga negativa, massa muito pequena e que se movem em órbitas ao redor do núcleo atômico.
O núcleo atômico é situado no centro do átomo e constituído por prótons que são partículas de carga positiva, cuja massa é aproximadamente 1.837 vezes superior a massa do elétron, e por nêutrons, partículas sem carga e com massa ligeiramente superior à dos prótons.
O átomo é eletricamente neutro, por possuir números iguais de elétrons e prótons.
O número de prótons no átomo se chama número atômico, este valor é utilizado para estabelecer o lugar de um determinado elemento na tabela periódica.
A tabela periódica é uma ordenação sistemática dos elementos químicos conhecidos.
Cada elemento se caracteriza por possuir um número de elétrons que se distribuem nos diferentes níveis de energia do átomo correspondente.
Os níveis energéticos ou camadas, são denominados pelos símbolos K, L, M, N, O, P e Q.
Cada camada possui uma quantidade máxima de elétrons. A camada mais próxima do núcleo K, comporta somente dois elétrons; a camada L, imediatamente posterior, oito, e assim sucessivamente.
Os elétrons da última camada (mais afastados do núcleo) são responsáveis pelo comportamento químico do elemento, por isso são denominados elétrons de valência.
O número de massa é equivalente à soma do número de prótons e nêutrons presentes no núcleo.
O átomo pode perder elétrons, carregando-se positivamente, é chamado de íon positivo (cátion).
Ao receber elétrons, o átomo se torna negativo, sendo chamado íon negativo (ânion).
O deslocamento dos elétrons provoca uma corrente elétrica, que dá origem a todos os fenômenos relacionados à eletricidade e ao magnetismo.
No núcleo do átomo existem duas forças de interação a chamada interação nuclear forte, responsável pela coesão do núcleo, e a interação nuclear fraca, ou força forte e força fraca respectivamente.
As forças de interação nuclear são responsáveis pelo comportamento do átomo quase em sua totalidade.
As propriedades físico-químicas de um determinado elemento são predominantemente dadas pela sua configuração eletrônica, principalmente pela estrutura da última camada, ou camada de valência.
As propriedades que são atribuídas aos elementos na tabela, se repetem ciclicamente, por isso se denominou como tabela periódica dos elementos.
Os isótopos são átomos de um mesmo elemento com mesmo número de prótons (podem ter quantidade diferente de nêutrons).
Os isótonos são átomos que possuem o mesmo número de nêutrons
Os Isóbaros são átomos que possuem o mesmo número de massa
Através da radioatividade alguns átomos atuam como emissores de radiação nuclear, esta constitui a base do uso da energia atômica.O atual modelo atômico
Se sabe que os elétrons possuem carga negativa, massa muito pequena e que se movem em órbitas ao redor do núcleo atômico.
O núcleo atômico é situado no centro do átomo e constituído por prótons que são partículas de carga positiva, cuja massa é aproximadamente 1.837 vezes superior a massa do elétron, e por nêutrons, partículas sem carga e com massa ligeiramente superior à dos prótons.
O átomo é eletricamente neutro, por possuir números iguais de elétrons e prótons.
O número de prótons no átomo se chama número atômico, este valor é utilizado para estabelecer o lugar de um determinado elemento na tabela periódica.
A tabela periódica é uma ordenação sistemática dos elementos químicos conhecidos.
Cada elemento se caracteriza por possuir um número de elétrons que se distribuem nos diferentes níveis de energia do átomo correspondente.
Os níveis energéticos ou camadas, são denominados pelos símbolos K, L, M, N, O, P e Q.
Cada camada possui uma quantidade máxima de elétrons. A camada mais próxima do núcleo K, comporta somente dois elétrons; a camada L, imediatamente posterior, oito, e assim sucessivamente.
Os elétrons da última camada (mais afastados do núcleo) são responsáveis pelo comportamento químico do elemento, por isso são denominados elétrons de valência.
O número de massa é equivalente à soma do número de prótons e nêutrons presentes no núcleo.
O átomo pode perder elétrons, carregando-se positivamente, é chamado de íon positivo (cátion).
Ao receber elétrons, o átomo se torna negativo, sendo chamado íon negativo (ânion).
O deslocamento dos elétrons provoca uma corrente elétrica, que dá origem a todos os fenômenos relacionados à eletricidade e ao magnetismo.
No núcleo do átomo existem duas forças de interação a chamada interação nuclear forte, responsável pela coesão do núcleo, e a interação nuclear fraca, ou força forte e força fraca respectivamente.
As forças de interação nuclear são responsáveis pelo comportamento do átomo quase em sua totalidade.
As propriedades físico-químicas de um determinado elemento são predominantemente dadas pela sua configuração eletrônica, principalmente pela estrutura da última camada, ou camada de valência.
As propriedades que são atribuídas aos elementos na tabela, se repetem ciclicamente, por isso se denominou como tabela periódica dos elementos.
Os isótopos são átomos de um mesmo elemento com mesmo número de prótons (podem ter quantidade diferente de nêutrons).
Os isótonos são átomos que possuem o mesmo número de nêutrons
Os Isóbaros são átomos que possuem o mesmo número de massa
Através da radioatividade alguns átomos atuam como emissores de radiação nuclear, esta constitui a base do uso da energia atômica.O atual modelo atômico
O atual modelo atômico
Se sabe que os elétrons possuem carga negativa, massa muito pequena e que se movem em órbitas ao redor do núcleo atômico.
O núcleo atômico é situado no centro do átomo e constituído por prótons que são partículas de carga positiva, cuja massa é aproximadamente 1.837 vezes superior a massa do elétron, e por nêutrons, partículas sem carga e com massa ligeiramente superior à dos prótons.
O átomo é eletricamente neutro, por possuir números iguais de elétrons e prótons.
O número de prótons no átomo se chama número atômico, este valor é utilizado para estabelecer o lugar de um determinado elemento na tabela periódica.
A tabela periódica é uma ordenação sistemática dos elementos químicos conhecidos.
Cada elemento se caracteriza por possuir um número de elétrons que se distribuem nos diferentes níveis de energia do átomo correspondente.
Os níveis energéticos ou camadas, são denominados pelos símbolos K, L, M, N, O, P e Q.
Cada camada possui uma quantidade máxima de elétrons. A camada mais próxima do núcleo K, comporta somente dois elétrons; a camada L, imediatamente posterior, oito, e assim sucessivamente.
Os elétrons da última camada (mais afastados do núcleo) são responsáveis pelo comportamento químico do elemento, por isso são denominados elétrons de valência.
O número de massa é equivalente à soma do número de prótons e nêutrons presentes no núcleo.
O átomo pode perder elétrons, carregando-se positivamente, é chamado de íon positivo (cátion).
Ao receber elétrons, o átomo se torna negativo, sendo chamado íon negativo (ânion).
O deslocamento dos elétrons provoca uma corrente elétrica, que dá origem a todos os fenômenos relacionados à eletricidade e ao magnetismo.
No núcleo do átomo existem duas forças de interação a chamada interação nuclear forte, responsável pela coesão do núcleo, e a interação nuclear fraca, ou força forte e força fraca respectivamente.
As forças de interação nuclear são responsáveis pelo comportamento do átomo quase em sua totalidade.
As propriedades físico-químicas de um determinado elemento são predominantemente dadas pela sua configuração eletrônica, principalmente pela estrutura da última camada, ou camada de valência.
As propriedades que são atribuídas aos elementos na tabela, se repetem ciclicamente, por isso se denominou como tabela periódica dos elementos.
Os isótopos são átomos de um mesmo elemento com mesmo número de prótons (podem ter quantidade diferente de nêutrons).
Os isótonos são átomos que possuem o mesmo número de nêutrons
Os Isóbaros são átomos que possuem o mesmo número de massa
Através da radioatividade alguns átomos atuam como emissores de radiação nuclear, esta constitui a base do uso da energia atômica.
Igor P.F da Rocha
O professor da universidade inglesa New College de Manchester, John Dalton foi o criador da primeira teoria atômica moderna na passagem do século XVIII para o século XIX.
Em 1803 Dalton publicou o trabalho Absorption of Gases by Water and Other Liquids, (Absorção de gases pela água e outros líquidos), neste delineou os princípios de seu modelo atômico.
Segundo Dalton:
Átomos de elementos diferentes possuem propriedades diferentes entre si.
Átomos de um mesmo elemento possuem propriedades iguais e de peso invariável.
Átomos são partículas maciças, indivisíveis e esféricas formadoras da matéria.
Nas reações químicas, os átomos permanecem inalterados.
Na formação dos compostos, os átomos entram em proporções numéricas fixas 1:1, 1:2, 1:3, 2:3, 2:5 etc.
O peso total de um composto é igual à soma dos pesos dos átomos dos elementos que o constituem.
Em 1808, Dalton propôs a teoria do modelo atômico, onde o átomo é uma minúscula esfera maciça, impenetrável, indestrutível, indivisível e sem carga. Todos os átomos de um mesmo elemento químico são idênticos. Seu modelo atômico foi chamado de modelo atômico da bola de bilhar.
Em 1810 foi publicada a obra New System of Chemical Philosophy (Novo sistema de filosofia química), nesse trabalho havia testes que provavam suas observações, como a lei das pressões parciais, chamada de Lei de Dalton, entre outras relativas à constituição da matéria.
Os átomos são indivisíveis e indestrutíveis;
Existe um número pequeno de elementos químicos diferentes na natureza;
Reunindo átomos iguais ou diferentes nas variadas proporções, podemos formar todas as matérias do universo conhecidas;
Para Dalton o átomo era um sistema contínuo. Apesar de um modelo simples, Dalton deu um grande passo na elaboração de um modelo atômico, pois foi o que instigou na busca por algumas respostas e proposição de futuros modelos. Modelo de Dalton: A matéria é constituída de diminutas partículas amontoadas como laranjas.
Joseph John Thomson
A partir de uma experiência utilizando tubos de Crookes, Joseph John Thomson demonstrou que os raios catódicos podiam ser interpretados como um feixe de partículas carregadas negativamente e que possuíam massa. Concluiu que essas partículas negativas deviam fazer parte de quaisquer átomos, recebendo assim o nome de elétron.
O Modelo atômico de Thomson (1897) propunha então que se o átomo não fosse maciço (como havia afirmado John Dalton), mas sim um fluido com carga positiva (homogêneo e quase esférico) no qual estavam dispersos (de maneira homogênea) os elétrons. Podemos fazer a analogia desse modelo atômico com um "Panetone" ou com um pudim recheado de uvas passas, em que a massa do panetone seria positiva e as passas seriam as partículas negativas.
Ernest Rutherford
As bases para o desenvolvimento da física nuclear foram lançadas por Ernest Rutherford ao desenvolver sua teoria sobre a estrutura atômica. O cientista estudou por três anos o comportamento dos feixes de partículas ou raios X, além da emissão de radioatividade pelo elemento Urânio. Uma das inúmeras experiências realizadas, foi a que demonstrava o espalhamento das partículas alfa. Esta foi base experimental do modelo atômico do chamado átomo nucleado onde elétrons orbitavam em torno de um núcleo. Durante suas pesquisas Rutherford observou que para cada 10.000 partículas alfa aceleradas incidindo numa lâmina de ouro, apenas uma refletia ou se desviava de sua trajetória. A conclusão foi que o raio de um átomo poderia ser em torno de 10.000 vezes maior que o raio de seu núcleo. Rutherford e Frederick Soddy ainda, descobriram a existência dos raios gama e estabeleceram as leis das transições radioativas das séries do tório, do actínio e do rádio O modelo atômico de Rutherford ficou conhecido como modelo planetário, pela sua semelhança com a formação do Sistema Solar. Em 1911, Ernest Rutherford propôs o modelo de átomo com movimentos planetários. Este modelo foi estudado e aperfeiçoado por Niels Bohr, que acabou por demonstrar a natureza das partículas alfa como núcleos de hélio.
Niels Bohr
A teoria orbital de Rutherford encontrou uma dificuldade teórica resolvida por Niels Bohr.
No momento em que temos uma carga elétrica negativa composta pelos elétrons girando ao redor de um núcleo de carga positiva, este movimento gera uma perda de energia devido a emissão de radiação constante. Num dado momento, os elétrons vão se aproximar do núcleo num movimento em espiral e cair sobre si.
Em 1911, Niels Bohr publicou uma tese que demonstrava o comportamento eletrônico dos metais. Na mesma época, foi trabalhar com Ernest Rutherford em Manchester, Inglaterra. Lá obteve os dados precisos do modelo atômico, que iriam lhe ajudar posteriormente.
Em 1913, observando as dificuldades do modelo de Rutherford, Bohr intensificou suas pesquisas visando uma solução teórica.
Em 1916, Niels Bohr retornou para Copenhague para atuar como professor de física. Continuando suas pesquisas sobre o modelo atômico de Rutherford.
Em 1920, nomeado diretor do Instituto de Física Teórica, Bohr acabou desenvolvendo um modelo atômico que unificava a teoria atômica de Rutherford e a teoria da mecânica quântica de Max Planck.
Sua teoria consistia que ao girar em torno de um núcleo central, os elétrons deveriam girar em órbitas específicas com níveis energéticos bem definidos. Que poderia haver a emissão ou absorção de pacotes discretos de energia chamados de quanta ao mudar de órbita.
Realizando estudos nos elementos químicos com mais de dois elétrons, concluiu que se tratava de uma organização bem definida em camadas. Descobriu ainda que as propriedades químicas dos elementos eram determinadas pela camada mais externa.
Bohr enunciou o princípio da complementaridade, segundo o qual um fenômeno físico deve ser observado a partir de dois pontos de vista diferentes e não excludentes. Observou que existiam paradoxos onde poderia haver o comportamento de onda e de partícula dos elétrons, dependendo do ponto de vista.
Essa teoria acabou por se transformar na hipótese proposta por Louis de Broglie (Louis Victor Pierre Raymondi, sétimo duque de Broglie) onde todo corpúsculo atômico pode comportar-se de duas formas, como onda e como partícula.
Erwin Schrödinger, Louis Victor de Broglie e Werner Heisenberg
Erwin Schrödinger, Louis Victor de Broglie e Werner Heisenberg, reunindo os conhecimentos de seus predecessores e contemporâneos, acabaram por desenvolver uma nova teoria do modelo atômico, além de postular uma nova visão, chamada de mecânica ondulatória.
Fundamentada na hipótese proposta por Broglie onde todo corpúsculo atômico pode comportar-se como onda e como partícula, Heisenberg, em 1925, postulou o princípio da incerteza.
A idéia de órbita eletrônica acabou por ficar desconexa, sendo substituída pelo conceito de probabilidade de se encontrar num instante qualquer um dado elétron numa determinada região do espaço.
O átomo deixou de ser indivisível como acreditavam filósofos gregos antigos e Dalton. O modelo atômico portanto, passou a se constituir na verdade, de uma estrutura mais complexa.
O atual modelo atômico
Se sabe que os elétrons possuem carga negativa, massa muito pequena e que se movem em órbitas ao redor do núcleo atômico.
O núcleo atômico é situado no centro do átomo e constituído por prótons que são partículas de carga positiva, cuja massa é aproximadamente 1.837 vezes superior a massa do elétron, e por nêutrons, partículas sem carga e com massa ligeiramente superior à dos prótons.
O átomo é eletricamente neutro, por possuir números iguais de elétrons e prótons.
O número de prótons no átomo se chama número atômico, este valor é utilizado para estabelecer o lugar de um determinado elemento na tabela periódica.
A tabela periódica é uma ordenação sistemática dos elementos químicos conhecidos.
Cada elemento se caracteriza por possuir um número de elétrons que se distribuem nos diferentes níveis de energia do átomo correspondente.
Os níveis energéticos ou camadas, são denominados pelos símbolos K, L, M, N, O, P e Q.
Cada camada possui uma quantidade máxima de elétrons. A camada mais próxima do núcleo K, comporta somente dois elétrons; a camada L, imediatamente posterior, oito, e assim sucessivamente.
Os elétrons da última camada (mais afastados do núcleo) são responsáveis pelo comportamento químico do elemento, por isso são denominados elétrons de valência.
O número de massa é equivalente à soma do número de prótons e nêutrons presentes no núcleo.
O átomo pode perder elétrons, carregando-se positivamente, é chamado de íon positivo (cátion).
Ao receber elétrons, o átomo se torna negativo, sendo chamado íon negativo (ânion).
O deslocamento dos elétrons provoca uma corrente elétrica, que dá origem a todos os fenômenos relacionados à eletricidade e ao magnetismo.
No núcleo do átomo existem duas forças de interação a chamada interação nuclear forte, responsável pela coesão do núcleo, e a interação nuclear fraca, ou força forte e força fraca respectivamente.
As forças de interação nuclear são responsáveis pelo comportamento do átomo quase em sua totalidade.
As propriedades físico-químicas de um determinado elemento são predominantemente dadas pela sua configuração eletrônica, principalmente pela estrutura da última camada, ou camada de valência.
As propriedades que são atribuídas aos elementos na tabela, se repetem ciclicamente, por isso se denominou como tabela periódica dos elementos.
Os isótopos são átomos de um mesmo elemento com mesmo número de prótons (podem ter quantidade diferente de nêutrons).
Os isótonos são átomos que possuem o mesmo número de nêutrons
Os Isóbaros são átomos que possuem o mesmo número de massa
Através da radioatividade alguns átomos atuam como emissores de radiação nuclear, esta constitui a base do uso da energia atômica.
O atual modelo atômico
Se sabe que os elétrons possuem carga negativa, massa muito pequena e que se movem em órbitas ao redor do núcleo atômico.
O núcleo atômico é situado no centro do átomo e constituído por prótons que são partículas de carga positiva, cuja massa é aproximadamente 1.837 vezes superior a massa do elétron, e por nêutrons, partículas sem carga e com massa ligeiramente superior à dos prótons.
O átomo é eletricamente neutro, por possuir números iguais de elétrons e prótons.
O número de prótons no átomo se chama número atômico, este valor é utilizado para estabelecer o lugar de um determinado elemento na tabela periódica.
A tabela periódica é uma ordenação sistemática dos elementos químicos conhecidos.
Cada elemento se caracteriza por possuir um número de elétrons que se distribuem nos diferentes níveis de energia do átomo correspondente.
Os níveis energéticos ou camadas, são denominados pelos símbolos K, L, M, N, O, P e Q.
Cada camada possui uma quantidade máxima de elétrons. A camada mais próxima do núcleo K, comporta somente dois elétrons; a camada L, imediatamente posterior, oito, e assim sucessivamente.
Os elétrons da última camada (mais afastados do núcleo) são responsáveis pelo comportamento químico do elemento, por isso são denominados elétrons de valência.
O número de massa é equivalente à soma do número de prótons e nêutrons presentes no núcleo.
O átomo pode perder elétrons, carregando-se positivamente, é chamado de íon positivo (cátion).
Ao receber elétrons, o átomo se torna negativo, sendo chamado íon negativo (ânion).
O deslocamento dos elétrons provoca uma corrente elétrica, que dá origem a todos os fenômenos relacionados à eletricidade e ao magnetismo.
No núcleo do átomo existem duas forças de interação a chamada interação nuclear forte, responsável pela coesão do núcleo, e a interação nuclear fraca, ou força forte e força fraca respectivamente.
As forças de interação nuclear são responsáveis pelo comportamento do átomo quase em sua totalidade.
As propriedades físico-químicas de um determinado elemento são predominantemente dadas pela sua configuração eletrônica, principalmente pela estrutura da última camada, ou camada de valência.
As propriedades que são atribuídas aos elementos na tabela, se repetem ciclicamente, por isso se denominou como tabela periódica dos elementos.
Os isótopos são átomos de um mesmo elemento com mesmo número de prótons (podem ter quantidade diferente de nêutrons).
Os isótonos são átomos que possuem o mesmo número de nêutrons
Os Isóbaros são átomos que possuem o mesmo número de massa
Através da radioatividade alguns átomos atuam como emissores de radiação nuclear, esta constitui a base do uso da energia atômica.O atual modelo atômico
Se sabe que os elétrons possuem carga negativa, massa muito pequena e que se movem em órbitas ao redor do núcleo atômico.
O núcleo atômico é situado no centro do átomo e constituído por prótons que são partículas de carga positiva, cuja massa é aproximadamente 1.837 vezes superior a massa do elétron, e por nêutrons, partículas sem carga e com massa ligeiramente superior à dos prótons.
O átomo é eletricamente neutro, por possuir números iguais de elétrons e prótons.
O número de prótons no átomo se chama número atômico, este valor é utilizado para estabelecer o lugar de um determinado elemento na tabela periódica.
A tabela periódica é uma ordenação sistemática dos elementos químicos conhecidos.
Cada elemento se caracteriza por possuir um número de elétrons que se distribuem nos diferentes níveis de energia do átomo correspondente.
Os níveis energéticos ou camadas, são denominados pelos símbolos K, L, M, N, O, P e Q.
Cada camada possui uma quantidade máxima de elétrons. A camada mais próxima do núcleo K, comporta somente dois elétrons; a camada L, imediatamente posterior, oito, e assim sucessivamente.
Os elétrons da última camada (mais afastados do núcleo) são responsáveis pelo comportamento químico do elemento, por isso são denominados elétrons de valência.
O número de massa é equivalente à soma do número de prótons e nêutrons presentes no núcleo.
O átomo pode perder elétrons, carregando-se positivamente, é chamado de íon positivo (cátion).
Ao receber elétrons, o átomo se torna negativo, sendo chamado íon negativo (ânion).
O deslocamento dos elétrons provoca uma corrente elétrica, que dá origem a todos os fenômenos relacionados à eletricidade e ao magnetismo.
No núcleo do átomo existem duas forças de interação a chamada interação nuclear forte, responsável pela coesão do núcleo, e a interação nuclear fraca, ou força forte e força fraca respectivamente.
As forças de interação nuclear são responsáveis pelo comportamento do átomo quase em sua totalidade.
As propriedades físico-químicas de um determinado elemento são predominantemente dadas pela sua configuração eletrônica, principalmente pela estrutura da última camada, ou camada de valência.
As propriedades que são atribuídas aos elementos na tabela, se repetem ciclicamente, por isso se denominou como tabela periódica dos elementos.
Os isótopos são átomos de um mesmo elemento com mesmo número de prótons (podem ter quantidade diferente de nêutrons).
Os isótonos são átomos que possuem o mesmo número de nêutrons
Os Isóbaros são átomos que possuem o mesmo número de massa
Através da radioatividade alguns átomos atuam como emissores de radiação nuclear, esta constitui a base do uso da energia atômica.O atual modelo atômico
O atual modelo atômico
Se sabe que os elétrons possuem carga negativa, massa muito pequena e que se movem em órbitas ao redor do núcleo atômico.
O núcleo atômico é situado no centro do átomo e constituído por prótons que são partículas de carga positiva, cuja massa é aproximadamente 1.837 vezes superior a massa do elétron, e por nêutrons, partículas sem carga e com massa ligeiramente superior à dos prótons.
O átomo é eletricamente neutro, por possuir números iguais de elétrons e prótons.
O número de prótons no átomo se chama número atômico, este valor é utilizado para estabelecer o lugar de um determinado elemento na tabela periódica.
A tabela periódica é uma ordenação sistemática dos elementos químicos conhecidos.
Cada elemento se caracteriza por possuir um número de elétrons que se distribuem nos diferentes níveis de energia do átomo correspondente.
Os níveis energéticos ou camadas, são denominados pelos símbolos K, L, M, N, O, P e Q.
Cada camada possui uma quantidade máxima de elétrons. A camada mais próxima do núcleo K, comporta somente dois elétrons; a camada L, imediatamente posterior, oito, e assim sucessivamente.
Os elétrons da última camada (mais afastados do núcleo) são responsáveis pelo comportamento químico do elemento, por isso são denominados elétrons de valência.
O número de massa é equivalente à soma do número de prótons e nêutrons presentes no núcleo.
O átomo pode perder elétrons, carregando-se positivamente, é chamado de íon positivo (cátion).
Ao receber elétrons, o átomo se torna negativo, sendo chamado íon negativo (ânion).
O deslocamento dos elétrons provoca uma corrente elétrica, que dá origem a todos os fenômenos relacionados à eletricidade e ao magnetismo.
No núcleo do átomo existem duas forças de interação a chamada interação nuclear forte, responsável pela coesão do núcleo, e a interação nuclear fraca, ou força forte e força fraca respectivamente.
As forças de interação nuclear são responsáveis pelo comportamento do átomo quase em sua totalidade.
As propriedades físico-químicas de um determinado elemento são predominantemente dadas pela sua configuração eletrônica, principalmente pela estrutura da última camada, ou camada de valência.
As propriedades que são atribuídas aos elementos na tabela, se repetem ciclicamente, por isso se denominou como tabela periódica dos elementos.
Os isótopos são átomos de um mesmo elemento com mesmo número de prótons (podem ter quantidade diferente de nêutrons).
Os isótonos são átomos que possuem o mesmo número de nêutrons
Os Isóbaros são átomos que possuem o mesmo número de massa
Através da radioatividade alguns átomos atuam como emissores de radiação nuclear, esta constitui a base do uso da energia atômica.
Igor P.F da Rocha
domingo, 28 de março de 2010
Modelo atômico Jonh Dalton
Jonh Dalton
Segundo Dalton:
- Átomos de elementos diferentes possuem propriedades diferentes entre si.
- Átomos de um mesmo elemento possuem propriedades iguais e de peso invariável.
- Átomos são partículas maciças, indivisíveis e esféricas formadoras da matéria.
- Nas reações químicas, os átomos permanecem inalterados.
- Na formação dos compostos, os átomos entram em proporções numéricas fixas 1:1, 1:2, 1:3, 2:3, 2:5 etc.
- O peso total de um composto é igual à soma dos pesos dos átomos dos elementos que o constituem.
- Os átomos são indivisíveis e indestrutíveis;
- Existe um número pequeno de elementos químicos diferentes na natureza;
- Reunindo átomos iguais ou diferentes nas variadas proporções, podemos formar todas as matérias do universo conhecidas
Modelos atômicos e seus criadores
Modelos atômicos:
Leucipo de Mileto Demócrito
Leucipo dizia que a matéria podia ser dividida em partículas cada vez menores, até chegar-se a um limite.
O filósofo grego Leucipo e seu discípulo Demócrito imaginaram a matéria como sendo constituída por pequenas partículas indivisíveis - os átomos, como lhes chamaram. Concluiram que a matéria não poderia ser infinitamente divisível. Se a partíssemos variadas vezes, chegaríamos a uma partícula muito pequena, indivisível e impenetrável a que se denominou átomo.
John Dalton
Dalton afirmava que o átomo era a partícula elementar, a menor partícula que constituía a matéria. Em 1.808, Dalton apresentou seu modelo atômico: o átomo como uma minúscula esfera maciça, indivisível, impenetrável e indestrutível. Dalton, ao contrário de Demócrito e Leucipo, utilizou de métodos experimentais, dando maior credibilidade ao seu modelo. Seu modelo atômico também é conhecido como "modelo da bola de bilhar".
Para ele, todos os átomos de um mesmo elemento químico são iguais, até mesmo as suas massas. Dalton estava completamente enganado ao afirmar isto, e Thomsom demonstrou que os mesmos podiam ser interpretados como sendo um feixe de partículas carregadas de energia elétrica negativa, as quais foram chamadas de elétrons.
J. J. Thomsom
Utilizando campos magnéticos e elétricos, Thomson conseguiu determinar a relação entre a carga e a massa do elétron. Ele conclui que os elétrons (raios catódicos) deveriam ser constituintes de todo tipo de matéria pois observou que a relação carga/massa do elétron era a mesma para qualquer gás que fosse colocado na Ampola de Crookes (tubo de vidro rarefeito no qual se faz descargas elétricas em campos elétricos e magnéticos). Com base em suas conclusões, Thomson colocou por terra o modelo do átomo indivisível e apresentou seu modelo, conhecido também como o "modelo de pudim com passas"
Modelo de Thomsom
Resumo da linha de raciocínio de Thomsom :
a matéria é formada por partículas extremamente pequenas chamadas átomos;
os átomos são esferas maciças, indestrutíveis e intransformáveis;
Átomos que apresentam mesmas propriedades (tamanho, massa e forma) constituem um elemento químico;
Átomos de elementos diferentes possuem propriedades diferentes;
os átomos podem se unir entre si formando "átomos compostos";
uma reação química nada mais é do que a união e separação de átomos
Ernest Rutherford
As bases para o desenvolvimento da física nuclear foram lançadas por Ernest Rutherford ao desenvolver sua teoria sobre a estrutura atômica. O cientista estudou por três anos o comportamento dos feixes de partículas ou raios X, além da emissão de radioatividade pelo elemento Urânio. Uma das inúmeras experiências realizadas foi a que demonstrava o espalhamento das partículas alfa. Esta foi base experimental do modelo atômico do chamado átomo nucleado onde elétrons orbitavam em torno de um núcleo. Durante suas pesquisas Rutherford observou que para cada 10.000 partículas alfa aceleradas incidindo numa lâmina de ouro, apenas uma refletia ou se desviava de sua trajetória. A conclusão foi que o raio de um átomo poderia ser em torno de 10.000 vezes maior que o raio de seu núcleo.
Experimento de Rutherford
Modelo atômico de Rutherford
Niels Bohr
Bohr apresentou alterações ao modelo de Rutherford: os elétrons só podem ocupar níveis de energia bem definidos, e os elétrons giram em torno do núcleo em órbitas com energias diferentes. As órbitas interiores apresentam energia mais baixa e à medida que se encontram mais afastadas do núcleo o valor da sua energia é maior. Quando um elétron recebe energia suficiente passa a ocupar uma órbita mais externa (com maior energia) ficando o átomo num estado excitado. Se um elétron passar de uma órbita para uma outra mais interior liberta energia.
Os elétrons tendem a ter a menor energia possível - estado fundamental do átomo.
Os elétrons tendem a ter a menor energia possível - estado fundamental do átomo.
Modelo atômico de Niels Bohr
Bibliografia
Aluno: Igor Fernandes Freitas
Assinar:
Postagens (Atom)